Микроклональное размножение орхидей, Вы точно человек?

РАН, Я в лабе выращивал фаленопсисы из семян. И в русском языке орхидея - женского рода. Show more. Мой Мирок Орхидей Микроклональное размножение.
Для освобождения от вирусной инфекции вычленяют эксплантаты от 0,1 до 0,5 мм и проводят ранее тестирование как протокормов, так и растений-регенерантов [31].
Основная трудность при микроразмножении орхидей состоит в получении асептического материала. Интактные растения находятся в симбиотических отношениях с различными микроорганизмами, поэтому процент контаминации бывает очень высок. Разработаны методы стерилизации эксплантов различных видов орхидных, обеспечивающие получение стерильного материала. Чаще всего в качестве источника эксплантов используют молодые отрастающие побеги и туберидии. При изучении морфогенетического потенциала сортов Cymbidium были отобраны 17 генотипов, обладающих высоким морфогенным потенциалом, высокой продуктивностью цветения и потому пригодных для использования в промышленном цветоводстве [34].
Рост эксплантов орхидей на питательных средах зависит от положения вычленяемых частей на интактном растении. Экспланты, вычлененные из нижней части побега или туберидия, быстрее формируют растения [35]. Как было отмечено выше, первым этапом микроразмножения орхидных является получение протокормов, которые служат основной структурной единицей при микроразмножении.
Экспланты орхидных, в зависимости от этапа микроразмножения, культивируют как на твердых, так и на жидких питательных средах. Формирование протокормов начинается через месяца после того как эксплант помещён на питательную среду. Полученные протокормы разделяют и переносят на свежие питательные среды. В дальнейшем размножение протокормов происходит в геометрической прогрессии.
Установлено, что закладка меристематических центров, образующих в дальнейшем вторичные протокормы происходит в эпидермальных и субэпидермальных слоях тела протокорма. Если конгломераты протокормов не разделять и не субкультивировать, то со временем они начинают формировать растения [31]. Перенос полученных in vitro ювенильных растений в септические условия весьма болезненный процесс для представителей многих видов.
Большинство тропикогенных орхидных хорошо переносят период адаптации при высадке в сфагновый мох с последующей пересадкой в легкие питательные землесмеси. В то же время некоторые виды, представители которых являются ярко выраженными эпифитами, необходимо сразу высаживать на блоки [36].
Таким образом, высокий экономический эффект семенного и клонального микроразмножения заключается не только в получении массового посадочного материала в течение кратчайших сроков вне зависимости от времени года, но и в оздоровлении растений от патогенов. Растения, полученные при размножении in vitro , сохраняют все отличительные особенности характерные виду, морфологически выровнены и имеют высокий коэффициент размножения при культивировании их в условиях оранжерей [32].
Что же касается сенполий, то размножение их in vitro требует очень высокой технологии производства. Зарубежные фирмы хорошо освоили этот метод. В России успешное микроклональное размножение сенполии было проведено в лабораторных условиях И только с года в научно-производственном центре "Фитогенетика" г. Тула, освоено промышленное производство сенполии. Сейчас она одна из самых популярных комнатных растений. В настоящее время коллекция центра насчитывает не менее сортов [37].
Клональное микроразмножение сенполии основано на их способности размножаться листовыми черенками. Причём в условиях in vitro возможна посадка на питательную среду не только целого листа без черешка , но и отдельных его фрагментов, хотя чем больше фрагмент листа, тем быстрее идёт образование каллусной ткани. Именно она даёт начало новым растениям: под действием гормонов на каллусной ткани образуются ростовые почки. Затем почки отделяют и пересаживают на свежую среду, где образуются целые пучки молодых растений.
Хорошо развитые растеньица укореняют на другой питательной среде [38]. Основные этапы микроклонального размножения сенполий in vitro :. Инициация культуры сенполии in vitro : стерильные экспланты кусочки листа, цветоноса, обработанные стерелизующим раствором помещают на искусственную питательную среду для размножения.
На этом этапе отдельные растения пересаживают на новую питательную среду для укоренения. Микророзетки высаживают в грунт или торфо-перегнойные таблетки и помещают в парник, где поддерживают высокую влажность воздуха в течение недель. По мере адаптации растений к естественным условиям, с началом активного роста, влажность воздуха постепенно снижают [39].
Весь процесс от начала введения в культуру до получения укоренённого растения занимает месяцев. Зато потом, в условиях in vitro растения множатся как грибы да и характер роста похожий. Такой высокий коэффициент размножения не даёт ни один другой способ. Однако размноженные таким способом фиалки имеют некоторые особенности.
Во-первых, они быстро развиваются и образуют V-образную мощную розетку листьев. Во вторых, клональное микроразмножение приводит к их омолаживанию, поэтому клонированные сенполии способны дольше и больше цвести [40]. Файловый архив студентов. По сути это плесень, вызывающая такие болезни как корневая гниль сахарной свеклы, черной ножки капусты, с которой борются очень многие аграрии и овощные семеноводы, ризоктониозная гниль хлопчатника, ризоктониоз картофеля и другие.
В общем это очень пакостная вещь. Проросток орхидеи с хорошим иммунитетом не пускает гриб дальше дозволенного ему предела, и таким образом получается симбиотическая связь между орхидеей и микоризой гриба, последняя в которой не хуже настоящих корней снабжает молодую орхидею водой и растворенными в ней питательными веществами. Но не так все радужно.
Из нескольких миллионов семян, созревающих в одной коробочке, до взрослых растений доживают всего несколько десятков. Потому что далеко не каждое семя попадает в достаточно влажную и при этом воздушную среду, не каждое семя находит нужные грибы и образует с ними симбиотическую связь.
Если у орхидейки вдруг просел иммунитет, то вместо того, чтобы питаться, она сама становится обедом грибницы.
В общем вы поняли, все сложно. Конечно же на заре введения орхидей в домашнее цветоводство люди старались воссоздавать для выращивания сеянцев условия, близкие к природным: подходящий субстрат, влажность, освещенность, температуру.
Селекционеры пытались выделять штаммы тех самых специальных грибов с корней взрослых растений, культивировали их и пытались "заражать" ими посевы… Но в идеальной искусственной среде плесень жрала все, и выход взрослых орхидей был чуть ли не хуже, чем в природе.
Поэтому человечество озаботилось поиском более продуктивных способов снабжения орхидных сеянцев необходимыми питательными веществами - напрямую, без участия грибов.
Логичным решением, которое пришло в голову американскому ботанику Льюису Кнудсону, было использовать для "вскармливания" орхосеянцев специальную смесь, содержащую все необходимые минеральные вещества и простые сахара, растворенные в воде. А чтобы семена не тонули, смесь он сделал желеобразной с помощью загустителя агар-агара.
Такая смесь очень похожа на микробиологическую, на которой культивируют штаммы различных бактерий и грибов, и соответственно очень приходится им по вкусу. Поэтому, чтобы питательная среда не была сожрана вместе с семенами патогенной микрофлорой, необходимо строго следить за изоляцией посевов от внешнего мира, иными словами - соблюдать стерильность.
Фамилией Кнудсона назвали питательную среду, на которой он вырастил сеянцы. С тех пор среда Кнудсона считается самой подходящей для этого дела, а такое стерильное микробиологическое вскармливание - чуть ли не единственный эффективный способ выращивания орхидей из семян.
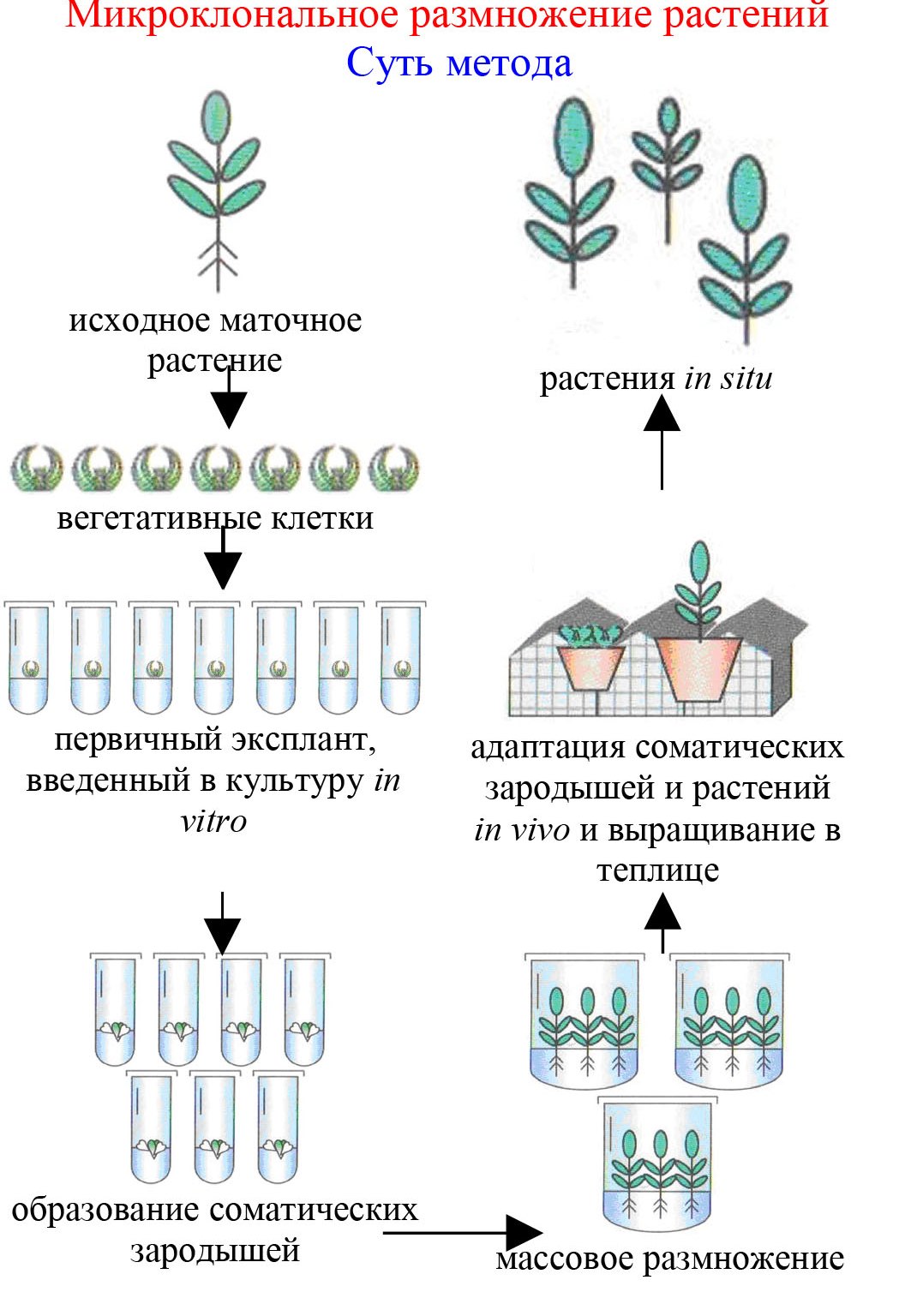
Поэтому, пока зрели мои семена, я взялась за комплектацию своей импровизированной домашней лаборатории. Помимо выращивания орхидей из семян мне было интересно заняться ещё и микроклональным, или меристемным , размножением растений. Меристема - простым языком это конгломерат верхушечных клеток внутри почки растения, из которых будет развиваться побег. Они представляют собой образующую ткань и активно делятся, формируя разные органы растущего побега.
И вот с растения берут одну почку, достают из нее эту самую меристему, сажают её, также как и семена, на стерильную питательную среду и выращивают ее. Важно подобрать подходящий состав среды, чтобы она думала, что она все еще на материнском растении, и ничего страшного не произошло. Если посадка прошла удачно, меристема начинает делиться.
Получается этакая масса неструктурированного биоматериала. В среду добавляют различные гормоны, тем самым инициируя рост тех или иных органов побегов и корней. То есть этот процесс управляемый: одни комбинации веществ побуждают рост побегов вверх, другие вызывают активное разрастание побегов в стороны - кущение, а третьи - дают команду роста корней. Таким образом, воздействуя на разных стадиях разными веществами, выращивают из массы недетерминированных клеток тысячи взрослых растений.
Звучит как волшебство. Для меня это действительно нечто магически манящее и притягательное. Еще в школе кабинеты биологии и химии вызывали в моей душе трепетное благоговение. И хоть ни химиком, ни биологом я не стала, лабораторная посуда: колбы, пробирки с растениями, дистилляторы, реторты, разноцветные жидкости и питательные среды - все это до сих пор приводит меня в неописуемый восторг.
Поэтому перспектива посвятить этому делу некоторую часть своего времени, внимания и жилплощади не то чтобы не вызвала отвращения, а наоборот была охотно воспринята и с воодушевлением принята к реализации. Но вернемся к нашим меристемкам. Описанию преимуществ и недостатков меристемного способа размножения растений можно посвятить целую статью, и это будет лишь повторение уже многократно сказанного.
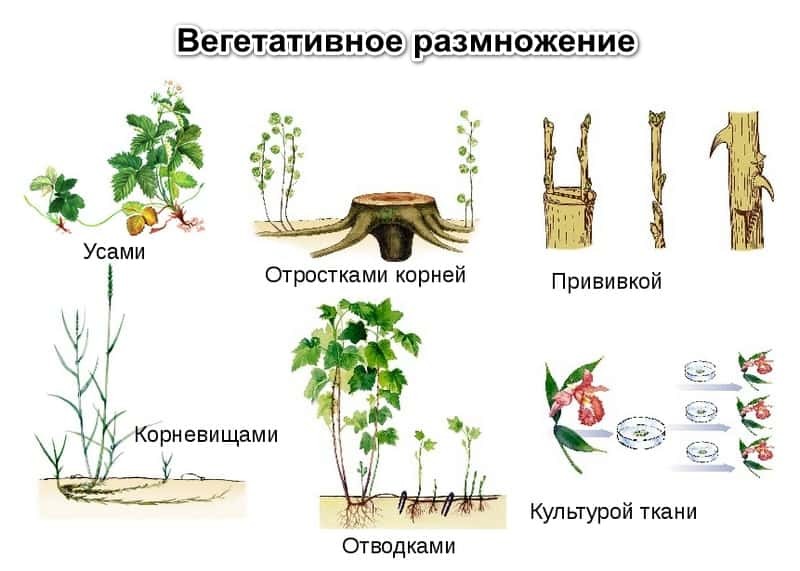
Здесь скажу лишь, что:. Из одной почки можно получить тысячи самостоятельных растений, в то время как другие способы вегетативного размножения дают на порядки более скромный результат. Таким образом можно очень эффективно размножить какую-нибудь редкую и интересную мутацию или сортовой признак. Единственное - слишком уж этот способ наукоемкий и довольно дорогой, но затраты того стоят. К тому же что для семян, что для меристемных черенков организация лаборатории и условия выращивания очень схожи, поэтому одно другому не помешает, а даже органично дополнит.
А в условиях грядущего глобального импортозамещения в связи с полным прекращением ввоза посадочного материала из Европы такие компетенции вообще в целом очень полезны для страны. В общем теперь, собственно, об организации моей домашней лаборатории. Первым делом для реализации моих наполеоновских планов необходимо было организовать стерильность на рабочем месте, а для этого нужно было заиметь ламинар.
Ламинар - это сердце любой биотехнологической лаборатории. Это специальный бокс, внутри которого создается ламинарный, то есть с постоянной скоростью и без завихрений, поток стерильного воздуха. Поток дует в направлении от задней стенки бокса к оператору. В этом потоке оператор может совершать стерильные операции без страха заразить среду и экспланты чем-либо из внешней среды. Самый простой фабричный ламинар на г.
Это был грандиозный проект, достойный отдельной статьи. Я изучила весь ру и не ру нет на предмет необходимых технических характеристик этого девайса, а также различные принципы его устройства. Люди делают всякое: от маленьких бытовых коробов из пластика с приделанными к ним пылесосами, до огромных и тяжелых конструкций из мебельных щитов с трехступенчатой фильтрацией воздуха промышленными фильтрами. Мне же хотелось, чтобы мой ламинар был компактный для размещения в однокомнатной квартире, но при этом с удобной и достаточной рабочей площадью.
Он должен быть лёгкий, чтобы я могла в одиночку перевезти его на новое место, должен сравнительно приятно выглядеть, поскольку всё-таки созерцать его придется у себя дома каждый день. Должен быть тихий и недорогой.
Ну и само собой он должен идеально выполнять свою функцию - создание и поддержание стерильного и ламинарного потока воздуха. Когда проект был разработан, а все необходимые материалы закуплены, мы закрылись с папой в гараже и примерно через неделю вышли оттуда с готовым ламинаром. Себестоимость порядка 40 рублей год.
Я обязательно напишу подробную статью о том, как это было. После того как сердце лаборатории забилось, дело осталось за малым: некоторое дополнительное оборудование, лабораторная посуда, технические жидкости и, собственно, сами химические ингредиенты, из которых предстояло варить среду.
Из дополнительного оборудования я сразу прикупила магнитную мешалку для приготовления растворов. Взяла импортную Китай модель с подогревом. Принцип работы у нее очень простой. По сути это электроплитка с вращающимся под ней магнитным элементом, который заставляет вращаться специальный магнитик, лежащий в стакане с раствором, стоящем на этой самой плитке.
Таким образом в жидкости внутри стакана создаётся вращающийся вихрь, перемешивающий все, что в него попадает. И всё это ещё и подогревается. Очень удобная штука - только засыпай ингредиенты, сама перемешивает, сама подогревает. Правда довести воду до кипения мощности не хватает - всего Вт, но до 80 градусов - вполне, и агар в ней расходится отлично. Стерилизацию питательных сред, посуды и инструментов первое время делала обычным кипячением на водяной бане в 5-литровой кастрюле.
Но один из экспериментов показал несостоятельность этого метода. При неполном погружении стерилизуемой посуды в воду происходит и не полная ее стерилизация. Горлышки бутылок с дистиллированной водой торчали из кастрюли. В итоге целая партия посаженных на питательную среду почек отправилась в мусорное ведро.
Выбор мой пал на литровый автоклав "Вятка" от Производственно-торговой компании Армада. Это самый маленький из их линейки автоклавов. Есть еще на 23 л и на 37 л, но пока на первое время мне хватит и самого маленького. Предназначен такой автоклав для приготовления консервов и домашних заготовок, и для моих целей он тоже подходит отлично. Общий язык с ним я нашла не сразу. В стеклянных банках с завинчивающимися крышками среда стерилизуется идеально, ничего не закипает, не выбивает и не деформируется.
А вот с пробирками, которые закрываются резиновыми пробками, а также с пластиковыми контейнерами вопрос пока открыт. При закипании среды в пробирке повышается давление и пробку выбивает. В итоге после стерилизации все пробирки открыты - весь процесс насмарку. Посоветовали не плотно закрывать пробирки и надевать на пробки бумажные колпачки на резинке. Они удержат пробку на пробирке при нагреве, а при остывании пробка сама втянется в пробирку.
Буду пробовать. Пластиковые контейнеры подходят не любые. Многие плавятся или деформируются при градусах. Заявлено, что они выдерживают соответственно до и градусов без деформации. Я пока в поиске таких контейнеров. Из измерительных приборов нужны очень точные весы. Для приготовления 1 л питательной среды некоторые вещества измеряются в сотых и тысячных долях миллиграмма, то есть это миллионные доли грамма.
У меня не очень точные китайские весы, которые способны ощутить лишь сотые грамма. Приходится изворачиваться и готовить так называемые маточные или стоковые растворы большей концентрации, из которых брать уже объем, содержащий необходимое количество нужного вещества.

Также нужен термометр для контроля температуры питательной среды и pH-метр для измерения кислотности растворов. Термометр я взяла стеклянный спиртовой на градусов в магазине химического оборудования, а pH-метр - электронный китайский из магазина продвинутого растениеводства или аквариумистики, точно не помню. В любом случае такой pH-метр можно легко приобрести на любом маркетплейсе.
Обязательно к нему нужно прикупить пару разных калибровочных растворов. По дополнительному оборудованию, пожалуй, все. Хочется, конечно, еще микроскоп, механические дозаторы, ручной осмофильтр для стерилизации методом фильтрования термолабильных чувствительных к температуре растворов… Но это уже бантики.
Основное - это ламинар, весы и автоклав. Кстати об осмофильтре. Установила себе бытовой Аквафор под раковину, чтобы под рукой всегда была дистиллированная вода.
Хотя дистиллят можно покупать и в магазине автозапчастей, и в Леруа вроде бы продавался, но дома под рукой удобнее.
Спирт использую этиловый. Держу в нем инструменты во время работы в ламинаре, а также обжигаю их на огне спиртовой горелки.
Изопропиловый спирт при сгорании образует вредные продукты сгорания и копоть, а этиловый хорошо горит, без запаха. Также спирт идет на протирание рук, поверхностей и стерилизацию эксплантов почек при посадке на питательную среду. Выдерживаю почки фаленопсисов в спирте 30 секунд. Затем на минут кладу их в раствор Белизны. Белизна, как и перекись водорода, нужна обязательно свежая. Со временем эти вещества теряют свои бактерицидные свойства.
При более крепком растворе увеличивается вероятность сильного отравления и гибели эксплантов. После выдержки в Белизне нужно обязательно минут по 10 промывать экспланты в дистиллированных стерильных водах. После этого можно сажать почки на питательную среду. Если все прошло удачно, заражения нет, они будут расти.
Пригодились на 0. В качестве замены можно использовать лезвия для бритвы с хирургическим держателем;. Такой сверток удобно переносить в ламинар с сохранением стерильности содержимого;. Ну и последнее и самое важное - это сами химические ингредиенты для приготовления питательных сред.
Пока у меня есть все микро и макро соли для приготовления:.